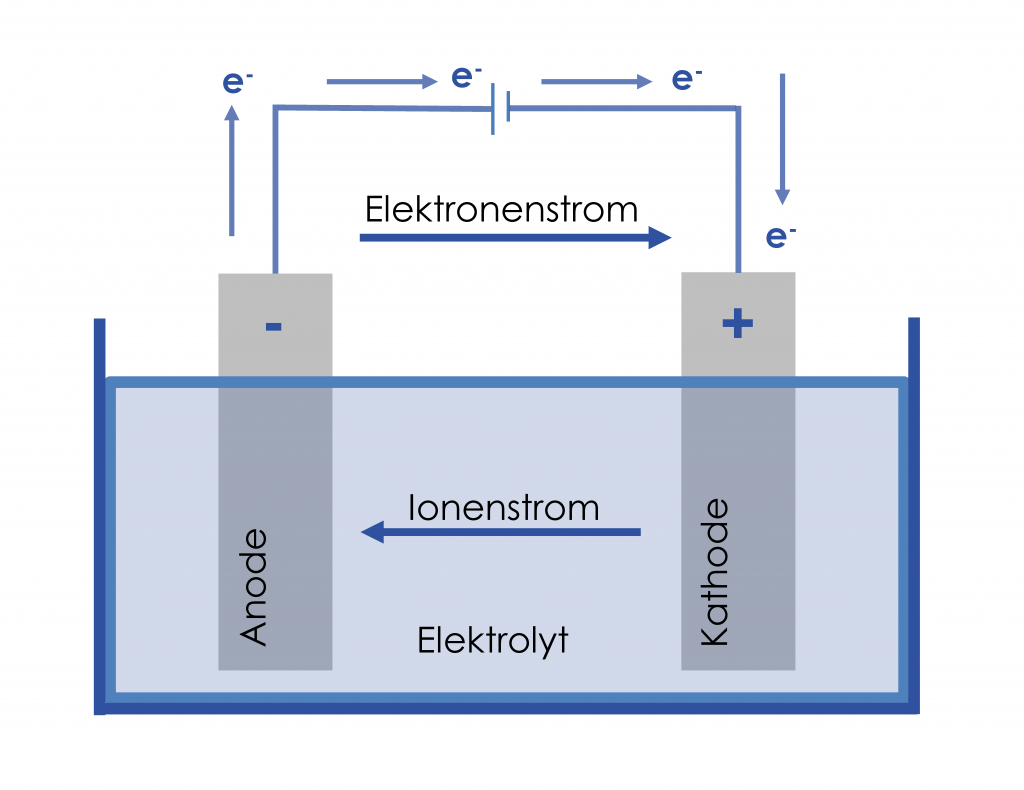
Die kleinste Einheit eines Akkumulators wird als galvanische Zelle bezeichnet. Diese besteht aus zwei leitenden Elektroden (Kathode und Anode) und einem Elektrolyten, einer elektrisch leitenden Flüssigkeit, in der sich die Ionen frei bewegen können.
Die Elektroden sind durch einen Separator, z. B. eine Membran, die nur für die Ionen durchlässig ist, voneinander getrennt. Damit ein Ladungsungleichgewicht entsteht und sich eine elektrische Spannung aufbauen kann, müssen die Elektroden ein unterschiedliches elektrochemisches Potenzial aufweisen. An der Anode herrscht Elektronenüberfluss, an der Kathode Elektronenmangel. Das Produkt aus dieser Ladungsdifferenz und der an der Batterie anliegenden elektrischen Spannung ergibt die elektrische Energie. Diese ergibt zusammen mit der im Elektrolyt gespeicherten chemischen Energie die gesamte Kapazität des Akkumulators.
Die Spannung, die sich zwischen den Elektroden aufbaut, nennt man Zellspannung. Sie ist je nach verwendeter Technologie unterschiedlich. Bei einem Blei-Akku beträgt sie z. B. 2 V, bei einem Li-Ionen-Akku etwa 3,8 V. Um höhere Spannungen im Akkumulator zu erhalten, werden mehrere Zellen in Reihe geschaltet. Wird an einen geladenen Akkumulator ein Verbraucher angeschlossen, fließt über diesen ein Strom (Elektronen) von der Anode zur Kathode. Diesem externen Elektronenstrom steht ein interner Ionenstrom im Elektrolyten gegenüber, was den Stromkreis schließt. Dadurch wird die Batterie entladen (siehe Abbildung zur galvanischen Zelle). Um den Akku wieder aufzuladen, wird an diesen eine Spannung angelegt, die die vorherige chemische Reaktion wieder rückgängig macht.


